Peptidlər, bir çox amin turşularının peptid istiqrazları ilə qurulması ilə yaranan birləşmələrin sinfidir. Canlı orqanizmlərdə onlar. İndiyə qədər canlı orqanizmlərdə on minlərlə peptid tapıldı. Peptidlər müxtəlif sistemlərin, orqanların, toxumaların və hüceyrələrin və həyat fəaliyyətlərində funksional fəaliyyətlərin tənzimlənməsində və çox vaxt funksional təhlil, antikor tədqiqatları, narkotik inkişafında və digər sahələrdə istifadə olunur. Biotexnologiya və peptid sintez texnologiyasının inkişafı ilə daha çox peptid dərmanı hazırlanmış və klinikada tətbiq edilmişdir.
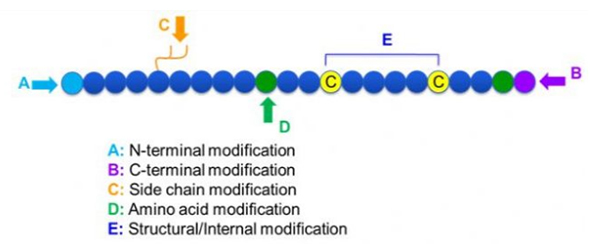
Sadəcə post modifikasiyası və proses modifikasiyasına bölünmək (alınmış amin turşusu modifikasiyası, C-terminal modifikasiyası, C-terminal modifikasiyası, yan zəncirli modifikasiya, skelet modifikasiyası, skelet modifikasiyası və s. (Şəkil 1). Peptid modifikasiyasının əsas zəncir quruluşunu və ya yan zəncir qruplarını dəyişdirmək, peptid birləşmələrinin fiziki və kimyəvi xüsusiyyətlərini effektiv şəkildə dəyişdirə, vivoda hərəkət vaxtını artırır, bioloji paylamağı dəyişdirir, zəhərli yan təsirləri azaldır və s. Bir neçə əsas peptid modifikasiya strategiyası və onların xüsusiyyətləri təqdim olunur.
1. Telosipedləşmə
Tsikli peptidlərin biomedicine-də bir çox tətbiqetmələri var və bioloji fəaliyyətlə bir çox təbii peptid tsiklik peptidlərdir. Çünki tsiklik peptidlər xətti peptidlərdən daha sərt olmağa meyllidirlər, həzm sisteminə son dərəcə davamlıdırlar, həzm sistemində sağ qala bilər və hədəf reseptorlar üçün daha güclü bir yaxınlıq nümayiş etdirə bilərlər. Velosipedləşmə, xüsusən də böyük struktur skeleti olan peptidlər üçün tsiklik peptidləri sintez etmək üçün ən birbaşa yoldur. Velosipedləşmə rejiminə görə, yan zəncirvari zəncir növünə bölmək olar, terminal - yan zəncir növü, terminal - terminal tipi (son tipə son).
(1) sidechain-to-sidechain
Yan zəncirvizmə üçün ən çox görülənin ən çox yayılmış tipi, sistein qalıqları arasında körpü düzəldilir. Bu velosipedləşmə, bir cüt sistein qalıqları tərəfindən tərk edilərsə, disulfide istiqrazları düzəltmək üçün oksidləşdi. Poliksik sintezi sulfhidryl qoruma qruplarının seçmə çıxarılması ilə əldə edilə bilər. Velosipedləşmə, ya da sonrakı bir həlledicində və ya əvvəlcədən yayılmış qatranda edilə bilər. Qatranlardakı tsikləşmə həlledici velosipedləşmədən daha az təsirli ola bilər, çünki qatranlardakı peptidlər çox velosipedli konformasiyalar hazırlamır. Yan zəncirvari zəncirvari velosiped sürücüsü, aspartik turşu və ya glutamik turşu qalığı və əsas amin turşusu arasındakı bir amin quruluşunun meydana gəlməsidir ki, bu da Side Qoruyucu Qrupu ya da qatranda və ya didikdən sonra polipeptiddən seçilə bilməlidir. Üçüncü növ yan zəncirvari zənciralı tsikləşmə tirozin və ya p-hidroksiphypheniljlycine difenil efirlərinin meydana gəlməsidir. Təbii məhsullarda bu titləşmə növü yalnız mikrob məhsullarında tapılır və velosipedləşmə məhsulları tez-tez potensial dərman dəyəri olur. Bu birləşmələrin hazırlanması unikal reaksiya şəraiti tələb edir, buna görə də onlar adi peptidlərin sintezində tez-tez istifadə edilmir.

(2) terminal-to-sidechain
Terminal tərəfi zəncirvizmə tsikləşməsi, ümumiyyətlə, lizin və ya ornitin yan zəncirinin amin və ya ornitine yan zəncirinin və ya n-terminal ilə C-terminalını əhatə edir. Digər polipeptid velosipedləşməsi Terminal C və Serin və ya Threonine Yan zəncirləri arasında eter istiqrazları yaratmaqla edilir.
(3) Terminal və ya baş-quyruq növü
Zəncir polipeptidləri ya solventdə, ya da yan zəncirvari velosiped sürəti ilə bir qatranda sabit ola bilər. Peptidlərin aşağı konsentrasiyaları, peptidlərin oliqomerizasiyasının qarşısını almaq üçün həlledici mərkəzləşdirmədə istifadə edilməlidir. Bir başdan-quyu sintetik üzük polipeptidinin məhsuldarlığı zəncir polipeptidinin ardıcıllığından asılıdır. Buna görə, böyük bir miqyasda tsiklik peptidləri hazırlamadan əvvəl, mümkün zəncirlənmiş qurğuşun peptidlərinin bir kitabxanası əvvəlcə ən yaxşı nəticələrlə ardıcıllığı tapmaq üçün tsikləşmə ilə yaradılmalıdır.
2. N-metilasiya
N-metilation əvvəlcə təbii peptidlərdə baş verir və hidrogen bağlarının meydana gəlməsinin qarşısını almaq üçün peptid sintezinə təqdim olunur, bununla da biodeqradasiyaya və rəsmiləşdirilməsinə daha çox peptid hazırlamaq üçün peptid sintezinə təqdim olunur. N-metilated amin turşusu törəmələrindən istifadə edərək peptidlərin sintezi ən vacib üsuldur. Bundan əlavə, metanol ilə polipeptid-qatran olan n- (2 nitrobenzen sulfonil xloridin reaksiyası da istifadə edilə bilər. Bu üsul, N-metilated amin turşuları olan tsiklik peptid kitabxanalarını hazırlamaq üçün istifadə edilmişdir.
3. Fosforylation
Fosforylation, təbiətdəki ən çox yayılmış post-tərcümə dəyişikliklərindən biridir. İnsan hüceyrələrində, zülalların 30% -dən çoxu fosforləşdirilmişdir. FosforyLation, xüsusilə geri çevrilən fosforasyon, siqnal köçürülməsi, gen ifadəsi, mobil dövrü və sitoskeleton tənzimlənməsi, sitoskeleton tənzimlənməsi və apoptoz kimi bir çox mobil proseslərə nəzarət etməkdə mühüm rol oynayır.
Fosforylation müxtəlif amin turşusu qalıqlarında müşahidə edilə bilər, lakin ən çox yayılmış fosforlaşma hədəfləri serin, threonine və tirozin qalıqlarıdır. Fosfotyrosine, fosfotreonine və fosfoserin törəmələri ya sintez zamanı peptidlərə, ya da peptid sintezindən sonra formalaşa bilər. Seçici fosforylation, qoruyucu qrupları seçici qrupları silməklə serin, threonine və tirozinlərin qalıqlarından istifadə edərək əldə edilə bilər. Bəzi fosforasiya reagentləri, post modifikasiyası ilə fosfor turşusu qruplarını polipeptidə də təqdim edə bilər. Son illərdə lizinin saytın xüsusi fosforasiyası kimyəvi cəhətdən selauditinger-fosfit reaksiyasından istifadə edərək əldə edilmişdir (Şəkil 3).

4. miristoylyasiya və palmitoylyasiya
N-terminalın yağ turşuları ilə aşınması peptidlər və ya zülallar hüceyrə membranlarına bağlamağa imkan verir. N-terminaldakı myRidamOyunlated ardıcıllığı SRC Ailə Protein kinazalarına və tərs transkripte GAQ zülallarını hüceyrə membranlarına bağlamağa yönəldir. Myristist turşusu standart bir cüt reaksiyalardan istifadə edərək qatran polipeptidinin n-terminalına bağlı idi və nəticədə lipopeptid standart şərtlərdə yayıla bilər və RP-HPLC tərəfindən təmizlənə bilər.
5. QLYKOSYLATION
Vancomycin və Teicolanin kimi glikopeptidlər, dərmanlara davamlı bakterial infeksiyaların müalicəsi üçün vacib antibiotiklərdir və digər glikopeptidlər tez-tez immunitet sistemini stimullaşdırmaq üçün istifadə olunur. Bundan əlavə, bir çox mikrobial antigenlər qlikozizli olduğundan, infeksiyanın terapevtik təsirinin yaxşılaşdırılması üçün glycopeptidlərin öyrənilməsi üçün çox əhəmiyyət kəsb edir. Digər tərəfdən, şiş hüceyrələrinin hüceyrə membranındakı zülallar, glikopeptidləri meydana gətirən anormal glikosylasiyanı nümayiş etdirir və bu da xərçəng və şiş müdafiə tədqiqatında mühüm rol oynayır. Glycopeptidlər FMOC / T-Bu metodu ilə hazırlanır. Threonine və Serin kimi glikosylated qalıqlar, tez-tez glikosylated amin turşularını qorumaq üçün Pentafluorophenol ester tərəfindən aktivləşdirilmiş FMOC-lər tərəfindən polipeptidlərə daxil edilir.
6. isopren
İSopentadiadiation, C-terminal yaxınlığında yan zəncirdə sistein qalıqlarında baş verir. Protein Isoprene hüceyrə membranının yaxınlığını yaxşılaşdıra və protein-protein qarşılıqlı əlaqəsini inkişaf etdirə bilər. Isopentadienated proteinlərə tirozin fosfatazası, kiçik GTase, Cochaperone molekulları, nüvə lamina və sentromerik bağlayıcı zülallar daxildir. İSopren polipeptidləri yenidən qatranlar üzərində isopren istifadə edərək və ya sistein törəmələri tətbiq etməklə hazırlana bilər.
7. polietilen glikol (Peg) modifikasiyası
Peg modifikasiyası, protein hidrolitik sabitliyi, bioodistribution və peptid həllini yaxşılaşdırmaq üçün istifadə edilə bilər. PEG zəncirlərinin peptidlərə tətbiqi onların farmakoloji xüsusiyyətlərini inkişaf etdirə bilər və proteolytik fermentlər tərəfindən peptidlərin hidrolizini də maneə törədir. Peg peptidlər, böyrək rəsmiləşdirilməsini çox azaltmaqla, glomerular kapilyar xaç bölməsindən daha asan olan adi peptidlərdən daha asan keçirlər. Vivoda dirək peptidlərinin uzadılmış aktivliyi, normal müalicə səviyyəsi aşağı dozalar və daha az tez-tez peptid dərmanları ilə qorunmaq olar. Bununla birlikdə, Peg modifikasiyası da mənfi təsir göstərir. Böyük miqdarda peq fermentin peptidin alçalmasına mane olmağa və peptidin hədəf reseptoruna bağlamasını da azaldır. Lakin Peg peptidlərinin 'aşağı cəhətləri, ümumiyyətlə, daha uzun bir farmakokinetik yarı ömrü ilə əvəz olunur və bədəndə daha uzun olmaqla, Peg peptidləri hədəf toxumalara sahib olmaq ehtimalı daha yüksəkdir. Buna görə PEG polimer xüsusiyyətləri optimal nəticələr üçün optimallaşdırılmalıdır. Digər tərəfdən, dirək peptidləri, böyrək rəsmiləşdirilməsi səbəbiylə qaraciyərdə yığılır, nəticədə makroomolekulyar sindrom. Buna görə, PEG dəyişiklikləri dərman testi üçün peptidlər istifadə edildikdə daha diqqətlə hazırlanmalıdır.

PEG dəyişdiricilərinin ümumi modifikasiya qrupları aşağıdakı kimi təqribən xülasə edilə bilər: amin (-amine) -nh2, aminometil-ch2, hidroky-oh, sulfhydryl (-tiol) -s N-Hydroşysuccinimide -nhs, akrilate-ch2ch2cooh, aldehid-ald, butyral P-toluenesulfonate -Ols, succinimide taccinate -s və s. Amino-aktivləşdirilmiş dirək aspartik turşu və ya glutamik turşu yan zəncirlərinə qoşula bilər. Mal-aktivləşdirilmiş dirək, tam tərk edilmiş sistein yan zəncirlərinin Merkaptan-a qoşula bilər [11]. Peg dəyişdiricilər ümumiyyətlə aşağıdakı kimi təsnif edilir (Qeyd: MPEG metoksiy-peg, ch3o- (ch2ch2o) n-ch2ch2-oh):
(1) Düz Zəncirli Peg dəyişdirici
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-ALD, MPEG-SS
(2) Bifunktion Peg dəyişdirici
HCOO-PEG-COOH, NH2-PEG-NH2, OH-Peg-Nh2, OH-Peg-Nh2, HCL · NH2-Peg-Cooh, Mal-Peg-Nhs
(3) Döşəmə PEG dəyişdirici
(MPEG) 2 NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-Mal
8. Biotinizasiya
Biotin, Avidin və ya Streptavidin ilə güclü şəkildə bağlana bilər və məcburi güc kovalent bağına bərabərdir. Biotin etiketli peptidlər, ümumiyyətlə immunoassay, histosittika və flüoresan əsaslı axın sitometriyasında istifadə olunur. Etiketli antibiotin antikorları da biotinilated peptidləri bağlamaq üçün istifadə edilə bilər. Biotin etiketləri tez-tez lizin yan zəncirinə və ya N terminalına yapışdırılır. 6-aminokaprosik turşusu tez-tez peptidlər və biotin arasındakı bir əlaqə kimi istifadə olunur. İstiqraz substrata bağlamaq və sterik əngəlin iştirakı ilə daha yaxşı bağlamağa çevikdir.
9. Floresan etiketləmə
Flüoresan etiketləmə, canlı hüceyrələrdə polipeptidləri izləmək və fermentlər və hərəkət mexanizmlərini öyrənmək üçün istifadə edilə bilər. Triptofan (TRP) flüoresandır, buna görə daxili etiketləmə üçün istifadə edilə bilər. Triptofanın emissiya spektri periferik mühitdən asılıdır və selvent polarite, peptid quruluşunu aşkar etmək və reseptor bağlaması üçün faydalı olan bir əmlak azalır. Triptophan flüoresancılığı, istifadəsini məhdudlaşdıra bilən etibarlı aspartik turşu və glutamik turşusu ilə söndürülə bilər. Dansylhloride Group (Dansyl), Amino qrupuna bağlı olduqda yüksək flüoresandır və tez-tez amin turşuları və ya zülallar üçün flüoresan etiket kimi istifadə olunur.
Floresance Rezonans Enerji Dönüşümü (Fret) ferment tədqiqatları üçün faydalıdır. Fret tətbiq edildikdə, substrat polipeptidində ümumiyyətlə flüoresan etiketli qrup və flüoresance-sorğu qrupu var. Etiketli flüoresan qruplar, foton olmayan enerji ötürücüsü vasitəsi ilə söndürülmüşdür. Peptid sual verən fermentdən ayrıldıqda, etiketləmə qrupu flüoresan yayımlayır.
10. qəfəs polipeptləri
Qəfəs peptidlərinin peptidini məcburi hala gətirən optik olaraq çıxarıla bilən qoruyucu qruplara malikdir. UB radiasiyasına məruz qaldıqda, peptid aktivləşdirilir, reseptora yaxınlığını bərpa edir. Çünki bu optik aktivləşdirmə zaman, amplituda və ya məkana görə idarə edilə bilər, qəfəs peptidləri hüceyrələrdə baş verən reaksiyalar öyrənmək üçün istifadə edilə bilər. Qəfəs polipeptidləri üçün ən çox istifadə olunan qoruyucu qruplar 2 nitrobenzil qrupları və onların törəmələri qoruyucu amin turşusu törəmələri vasitəsilə peptid sintezində tətbiq edilə bilən törəmələridir. İnkişaf etdirilən amin turşusu törəmələri lizin, sistein, serin və tirozindir. Aspartat və glutamat törəmələri, peptid sintezi və dağılması zamanı velosipedləşmələrə həssaslığı səbəbindən ümumiyyətlə istifadə edilmir.
11. Polyantigenic peptid (xəritə)
Qısa peptidlər ümumiyyətlə immunitetli deyil və antikorlar istehsal etmək üçün daşıyıcı zülallarla birləşdirilməlidir. Polyantigenik peptid (Xəritə), yüksək potensial immunogensləri xüsusi olaraq ifadə edə bilən və peptid daşıyıcısı protein cütləri hazırlamaq üçün istifadə edilə bilən Lizin Nüvə ilə əlaqəli çoxsaylı eyni peptidlərdən ibarətdir. Xəritə polipeptidləri xəritədə bərk faza sintezi ilə sintez edilə bilər. Bununla birlikdə, bəzi budaqlarda itkin və ya kəsilmiş peptid zəncirlərində natamam birləşmə nəticələri və beləliklə orijinal xəritə polipeptinin xüsusiyyətlərini nümayiş etdirmir. Alternativ olaraq, peptidlər ayrıca təmizlənə və təmizlənə bilər və sonra xəritəyə qoşula bilər. Peptidin nüvəsinə bağlı olan peptid ardıcıllığı, kütləvi spektrometriya ilə də asanlıqla xarakterizə olunur və asanlıqla xarakterizə olunur.
Rəy
Peptid modifikasiyası peptidlərin dizaynının vacib bir vasitəsidir. Kimyəvi dəyişdirilmiş peptidlər yalnız yüksək bioloji fəaliyyətini qoruya bilmir, həm də immunogen və toksikliklərin çatışmazlığından da təsirli ola bilər. Eyni zamanda, kimyəvi modifikasiya bəzi yeni əla xüsusiyyətlərə malik peptidlərə bəxş edə bilər. Son illərdə C-H polipeptidlərin post-to-modifikasiyası üçün aktivləşdirmə üsulu sürətlə inkişaf etmişdir və bir çox vacib nəticə əldə edilmişdir.
Time: 2025-07-03
